Wodór
Nie można go zobaczyć, nie ma zapachu ani smaku, a jest najbardziej rozpowszechnionym pierwiastkiem w kosmosie. Na Ziemi tworzy największą liczbę związków, głównie z węglem. Jest paliwem ekologicznym – w wyniku jego spalania powstaje woda. Dzięki niemu smarujesz kanapkę masłem roślinnym…

czym jest powietrze;
w jaki sposób należy posługiwać się układem okresowym;
jak w laboratorium można otrzymać tlen i tlenek węgla(IV);
w jaki sposób można zidentyfikować tlen, tlenek węgla(IV).
opisywać budowę atomu wodoru i omawiać właściwości tego pierwiastka;
planować metody otrzymywania i identyfikacji wodoru;
definiować pojęcie mieszaniny wybuchowej i stosować w praktyce zasady bezpieczeństwa w pracowni chemicznej;
analizować właściwości i zastosowanie wodoru.
1. Występowanie wodoru w przyrodzie
Wodór jest najbardziej rozpowszechnionym pierwiastkiem we wszechświecie (główny składnik gwiazd). Na Ziemi występuje w śladowych ilościach (w gazie ziemnym i wulkanicznym), natomiast tworzy liczne związki (np. wodę, białka, węglowodory, cukry).
Wodór jest pierwiastkiem, który został zapisany w układzie okresowym jako pierwszy, jednak nie należy do żadnej grupy. Ma najmniejszą masę atomową, dzięki czemu we wszystkich stanach skupienia jest substancją najlżejszą na świecie *(jako gaz 0,00009 g/cmIndeks górny 33, jako ciecz 0,07 g/cmIndeks górny 33 i jako substancja stała 0,08 g/cmIndeks górny 33 – jego gęstość w każdym ze stanów skupienia jest najmniejsza w porównaniu z innymi substancjami). Wodór tworzy cząsteczki dwuatomowe.
Ze względu na małą gęstość wodór był wykorzystywany do napełniania balonów i sterowców. Ich pierwowzorem był balon zaopatrzone w śmigło i napędzany maszyną parową.
Jednym z największych i najsłynniejszych sterowców był niemiecki Hindenburg, o długości 245 m i średnicy 41 m. Rozwijał on prędkość 135 km/h i mógł zabrać na pokład 72 pasażerów oraz 61 członków załogi. Latał do USA i Brazylii. Początkowo był napełniany helem, później dostosowano go do użycia wodoru (ze względu na embargo nałożone przez USA). W szesnastu zbiornikach Hindenburga mieściło się 200 tysięcy mIndeks górny 33 gazu. Szóstego maja 1937 roku podczas cumowania na lotnisku w Lakehurst (USA) sterowiec spłonął. W wypadku zginęło 35 osób (13 pasażerów i 22 osoby z załogi). Katastrofa zakończyła erę sterowców. Jednak maszyny te nie wyszły całkowicie z użytku. Dziś służą do lotów turystycznych i jako banery reklamowe, choć są plany zastosowania ich unowocześnionej wersji do celów militarnych oraz transportowych.

Na podstawie przeczytanego tekstu wyjaśnij, jakie właściwości ma wodór.
2. Otrzymywanie i badanie właściwości wodoru
W jaki sposób można otrzymać wodór?
Wybierz jedną z przedstawionych hipotez, a następnie zweryfikuj ją.
Wodór można otrzymać w reakcji niemetalu z kwasem.
Wodór można otrzymać w reakcji metalu z kwasem.
kolba stożkowa lub okrągłodenna,
korek z wkraplaczem i rurką odprowadzającą,
krystalizator,
dwie probówki,
korek,
statyw z łapą,
łuczywo,
kwas solny,
cynk.
Załóż okulary i rękawice ochronne.
Do kolby stożkowej lub kulistej wprowadź kilka granulek cynku.
Kolbę zamknij korkiem z wkraplaczem i rurką odprowadzającą.
Do wkraplacza wlej kwas solny.
Koniec rurki odprowadzającej umieść w krystalizatorze z wodą, w którym znajduje się odwrócona dnem do góry probówka wypełniona wodą.
Do kolby dodaj roztwór kwasu solnego za pomocą wkraplacza.
Wydzielający się gaz zbieraj do probówki.
Po zebraniu gazu zamknij probówkę korkiem.
Czynność powtórz, zbierając gaz do drugiej probówki.
Probówki umieść w statywie, jedną z nich do góry dnem, i szybkim ruchem wprowadź zapalone łuczywo.
Do drugiej probówki wypełnionej gazem zbliż zapalone łuczywo.
RHVPF39vQtgT11  Otrzymywanie wodoru w reakcji cynku z kwasem solnym (1a i 1 b). Identyfikacja wodoru (2)
Otrzymywanie wodoru w reakcji cynku z kwasem solnym (1a i 1 b). Identyfikacja wodoru (2)
W wyniku reakcji cynku z kwasem solnym wydziela się bezbarwny gaz, który w probówce „zajmuje miejsce” wody.
Zachodzącą reakcję chemiczną można zapisać następująco:
Wodór jest gazem palnym. Czysty wodór spala się spokojnie. Zapalone łuczywo włożone do probówki z czystym gazem powstającym w wyniku reakcji pali się spokojnie. Wodór zmieszany z małą ilością powietrza, spala się z charakterystycznym dźwiękiem.
W jaki sposób można otrzymać wodór?
Wodór można otrzymać w reakcji rozkładu wody.
aparat Hoffmanna,
źródło prądu stałego,
probówka,
kwas siarkowy(VI),
woda.
Aparat do elektrolizy (Hoffmanna) napełnij wodą (lekko zakwaszoną).
Włącz źródło prądu.
Obserwuj zmiany zachodzące na elektrodach.
Do wylotu kranu (nad katodą) zbliż wylot probówki. Otwórz kran tak, aby gaz przedostał się do jej wnętrza.
Do wylotu probówki zbliż palące się łuczywo.
W celu identyfikacji drugiego gazu zbliż tlące się łuczywo do końcówki drugiego ramienia aparatu i otwórz go. Obserwuj zachodzące zmiany.
RFtzXhU4Mt64F1  Zestaw do otrzymywania wodoru w aparacie Hoffmanna
Zestaw do otrzymywania wodoru w aparacie Hoffmanna
W wyniku rozkładu wody pod wpływem prądu elektrycznego otrzymuje się dwa rodzaje produktów gazowych: wodór i tlen. Zachodzącą reakcję chemiczną opisuje następujące równanie:
Wydzielający się w wyniku rozkładu wody wodór zajmuje (w tych samych warunkach ciśnienia i temperatury) objętość dwa razy większą od objętości wydzielającego się jednocześnie tlenu.
Zbliżenie zapalonego łuczywa do wylotu rurki wywołuje charakterystyczny dźwięk, towarzyszący spalaniu mieszaniny wodoru z powietrzem. Obecność tlenu sprawdzamy poprzez zbliżenie tlącego się łuczywa do wylotu rurki – oczekując jego rozpalenia się.
Zaproponuj doświadczenie, które pozwoli porównać gęstość wodoru z gęstością powietrza.
Jak zachowa się balon wypełniony wodorem, a jak – wypełniony powietrzem?
Jakie właściwości ma mieszanina wodoru z powietrzem?
Właściwości mieszaniny wodoru z powietrzem są inne niż właściwości poszczególnych składników mieszaniny.
kolba stożkowa lub kulista okrągłodenna,
korek z wkraplaczem i rurką odprowadzającą,
krystalizator,
statyw z łapą,
detergent (np. płyn do mycia naczyń),
łuczywo,
kwas solny,
cynk.
Załóż okulary i rękawice ochronne.
Do kolby stożkowej lub kulistej wprowadź kilka granulek cynku.
Kolbę zamknij korkiem z wkraplaczem i rurką odprowadzającą.
Koniec rurki odprowadzającej umieść w krystalizatorze z wodą i detergentem.
Do wkraplacza wlej kwas solny i otwórz kranik.
Gdy na powierzchni zbierze się piana, wyjmij koniec rurki z krystalizatora, a do powstałych baniek zbliż zapalone łuczywo.
*Nabierz odrobinę płynu na koniec rurki i wypuść tworzącą się bańkę w powietrze.
Wprowadzone do mieszaniny wodoru z powietrzem łuczywo spowodowało mały wybuch, jednocześnie było słychać głośny, charakterystyczny odgłos. Produktem reakcji spalania jest woda:
Mieszanina wodoru i tlenu po ogrzaniu lub pod wpływem iskry wybucha, dlatego należy zachować szczególną ostrożność w obecności wodoru.
*Bańki napełnione wodorem odrywają się od powierzchni i ulatują do góry, co świadczy o tym, że wodór jest gazem lżejszym od powietrza.

Film dostępny na portalu epodreczniki.pl
Animację rozpoczyna ujęcie pięciu metalowych zbiorników gazów z balonami naciągniętymi na kurki. Pod nimi znajdują się opisy gazów znajdujących się w butlach. Licząc od lewej są to: dwutlenek węgla, tlen, powietrze, hel i wodór. Następuje równoczesne odkręcenie wszystkich zaworów i napełnienie balonów. Balony odczepiają się od zaworów. Trzy pierwsze opadają na podłoże, przy czym balon z dwutlenkiem węgla bardzo szybko, a pozostałe powoli. Balony z helem i wodorem unoszą się i zatrzymują na suficie pomieszczenia, przy czym balon z wodorem unosi się szybciej.
Wodór jest gazem bezbarwnym, bezwonnym, słabo rozpuszczalnym w wodzie, pierwiastkiem o najmniejszej gęstości, około 14 razy lżejszym od powietrza. Jest gazem palnym – czysty, spala się bladoniebieskim płomieniem, ale nie podtrzymuje palenia. Mieszanina wodoru i tlenu pod wpływem ogrzewania lub iskry gwałtownie wybucha – jest to mieszanina piorunującamieszanina piorunująca, zwana dawniej powietrzem grzmiącym.
3. Zastosowanie wodoru
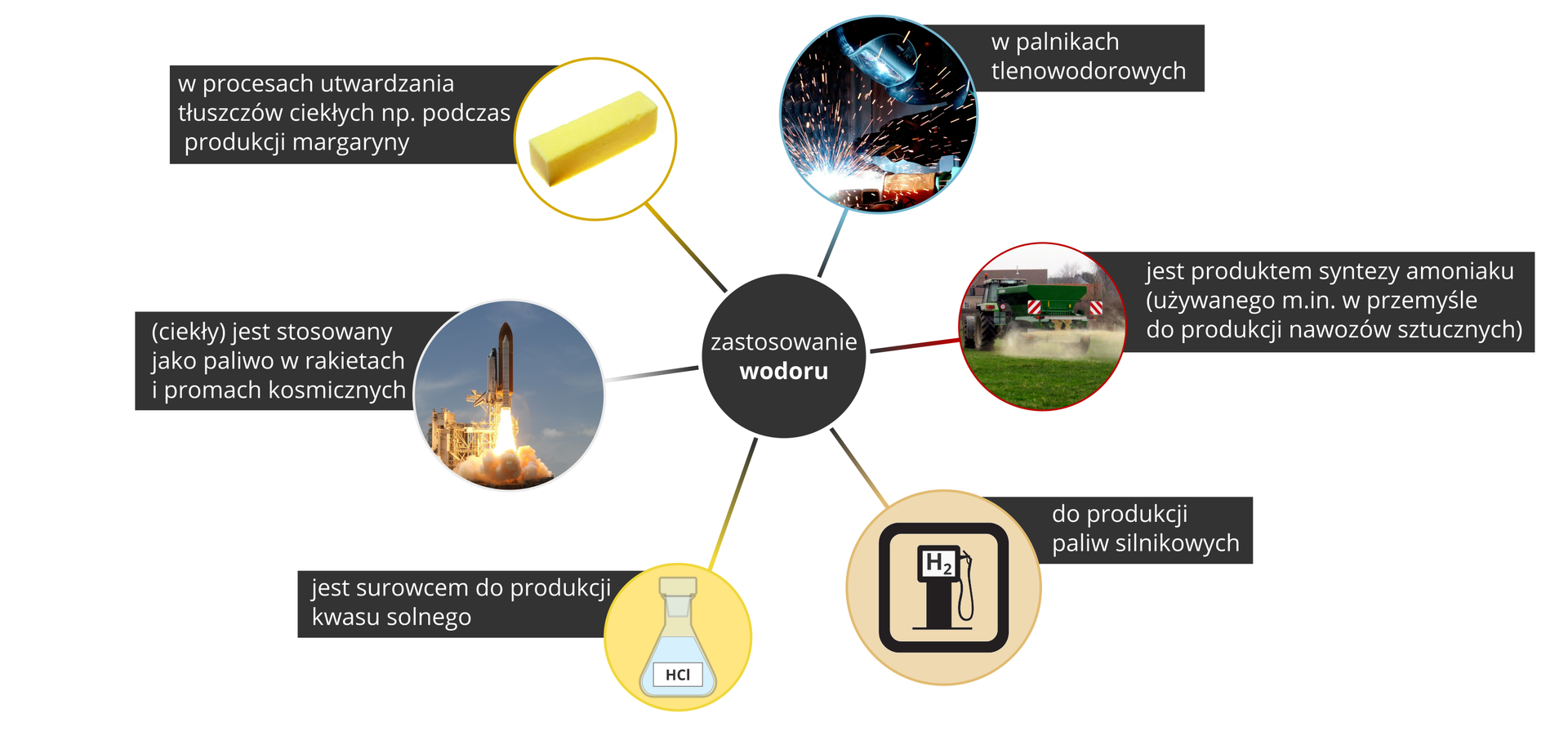
Wodór jest surowcem do syntezy amoniaku, używanego w przemyśle do produkcji nawozów sztucznych. Jako czynnik chłodzący jest on stosowany do zamrażania produktów spożywczych. Dawniej używano go także do przygotowywania sztucznych lodowisk.
Wodór jest stosowany w palnikach wodorowo‑tlenowych do precyzyjnego cięcia i spawania metali, m.in. przez jubilerów. W przemyśle spożywczym stosuje się go w procesie produkcji margaryny, a w przemyśle farmaceutycznym – do produkcji leków.
Obecnie coraz częściej wykorzystuje się specjalny rodzaj akumulatora, zwany ogniwem paliwowym (zamieniającym energię chemiczną na elektryczną). Ciekły wodór jest także stosowany jako paliwo napędowe promów kosmicznych.
Wodór paliwem przyszłości?
Gazety alarmują: Co będzie, gdy zabraknie ropy?
, albo Spaliny samochodów przyczyną przedwczesnej śmierci
. Rozwiązaniem obu problemów może okazać się wodór. Zasoby tego pierwiastka są nieskończone. Ponadto nie powoduje on zanieczyszczenia powietrza, ponieważ produktem jego spalania jest woda. Niestety, produkcja, skraplanie, transportowanie i magazynowanie wodoru są obecnie bardzo drogie. Prace w tym zakresie są obiektem zainteresowania firm motoryzacyjnych oraz instytucji badawczych. W 2012 roku naukowcy z Politechniki Lubelskiej zaprezentowali samochód napędzany wodorem.
Podsumowanie
Wodór jest pierwiastkiem najbardziej rozpowszechnionym we wszechświecie. W stanie wolnym tworzy cząsteczki dwuatomowe.
Czysty wodór pali się, ale nie podtrzymuje palenia. Jest gazem bezbarwnym, bezwonnym, o najmniejszej gęstości, około 14 razy lżejszym od powietrza. Z tlenem tworzy mieszaninę wybuchową.
Używa się go do produkcji amoniaku, kwasu solnego i margaryny oraz jako paliwa ekologicznego.
Przygotuj infografikę przedstawiającą zasady bezpiecznej pracy z wodorem i substancjami wybuchowymi.
Wyjaśnij, dlaczego sterowce są napełniane helem, mimo że ma on większą gęstość od wodoru.
Zaprojektuj doświadczenie pozwalające odróżnić bezbarwne gazy, pozbawione smaku i zapachu: tlen, tlenek węgla(IV), azot i wodór.
Korzystając z tablic chemicznych, napisz, w jakich warunkach ciśnienia i temperatury wodór jest cieczą.
Wyjaśnij zasadę działania bomby wodorowej.
Słowniczek

Henry Cavendish
Henry Cavendish (czyt. henry kawendisz) angielski fizykochemik. Zajmował się badaniem gazów i roztwarzaniem metali w kwasach. Jako pierwszy zauważył, że powstającym w wyniku tych reakcji gazem nie jest powietrze. Uważany za odkrywcę wodoru. Sformułował prawa znane jako prawo Ohma i prawo Coulomba, lecz nie opublikował ich.

Antoine Lavoisier
Francuski chemik Antoine Lavoisier (czyt. antła lawłazier), ojciec nowoczesnej chemii. Dzięki zastosowaniu metod ilościowych opisał proces spalania, obalając teorię flogistonową. Jego badania pozwoliły na uznanie wodoru za pierwiastek. Nazwał go hydrogenium (rodzący wodę).
silnie wybuchowa mieszanina wodoru z tlenem, w stosunku objętościowym 2:1; eksplozję mogą zainicjować iskra elektryczna, płomień lub wysoka temperatura
Zadania
Uzupełnij tekst, wybierając poprawne wyrażenia.
bezbarwnym, niepalny, symbol, wonnym (o słodkim zapachu), wonnym (o ostrym zapachu), bezwonnym, wonnym (o charakterystycznym zapachu), toksyczny, największej, mieszaniną, żółtym, zielonym, pierwiastkiem, palny, wzór, związkiem chemicznym, najmniejszej, żółtozielonym
Wodór jest .......................................................................... o .......................................................................... gęstości wśród wszystkich gazów. Jego .......................................................................... to . Jest .......................................................................... , .......................................................................... gazem. Czysty wodór jest ...........................................................................
Oceń, czy podane zdania są prawdziwe, czy fałszywe.
| Prawda | Fałsz | |
| Wodór jest stosowany w gaśnicach pianowych (jako środek gaśniczy). | □ | □ |
| Wodór jest surowcem do syntezy amoniaku. | □ | □ |
| Ciekły wodór jest stosowany jako paliwo napędzające promy kosmiczne. | □ | □ |
| Wodór jest stosowany do gazowania napojów. | □ | □ |
| Wodór służy do utwardzania ciekłych tłuszczów roślinnych. | □ | □ |