Rozpuszczalność substancji
Mówimy o niektórych substancjach, że bardzo dobrze rozpuszczają się w wodzie. Nie znaczy to jednak, że substancje te mieszają się z nią w nieograniczonym stosunku. Gdyby tak było, to każdą jej ilość można byłoby rozpuścić w jednej kropli wody.

że w wyniku rozpuszczania otrzymuje się roztwór;
że na szybkość rozpuszczania wpływają mieszanie, rozdrobnienie substancji rozpuszczanej, podwyższenie temperatury.
interpretować krzywe rozpuszczalności w celu określenia rozpuszczalności substancji;
rozróżniać pojęcia: roztwóoru nasyconego, roztworu nienasyconyego oraz roztworu rozcieńczonego i roztworu stężonego;
opisywać zmiany rozpuszczalności ciał stałych i gazów w wodzie w zależności od temperatury.
1. Czy w tej samej ilości wody rozpuszcza się taka sama ilość każdej substancji?
Czy w określonej objętości (masie) wody można rozpuścić jednakową masę różnych substancji?
Wybierz jedną z przedstawionych hipotez, a następnie zweryfikuj ją.
W tej samej objętości (masie) wody rozpuszczają się niejednakowe masy różnych substancji.
W tej samej objętości (masie) wody rozpuszczają się jednakowe masy różnych substancji.
zlewki,
bagietki,
łyżeczki,
woda,
siarczan(VI) miedzi(II),
chlorek sodu (sól kuchenna),
cukier spożywczy (sacharoza),
jodek potasu.
Do pięciu zlewek o jednakowej objętości wlej identyczną objętość wody (10 cmIndeks górny 33).
Do każdej z nich wsyp 3 g substancji:
do zlewki 1. – siarczanu(VI) miedzi(II),
do zlewki 2. – chlorku sodu,
do zlewki 3. – cukru spożywczego,
do zlewki 4. – jodku potasu.
Zawartość wszystkich zlewek mieszaj w identyczny sposób za pomocą bagietki.
Obserwuj szybkość zanikania poszczególnych substancji.
Po pewnym czasie chlorek sodu, cukier i jodek potasu uległy rozpuszczeniu. W zlewce z siarczanem(VI) miedzi(II) pozostały nierozpuszczone kryształy. W tej samej objętości wody i w tej samej temperaturze mogą rozpuścić się różne masy substancji.
W takiej samej objętości wody rozpuszczają się różne masy różnych substancji.
2. Czy ilość substancji rozpuszczanej zależy od temperatury rozpuszczalnika?
Czy temperatura ma wpływ na ilość substancji stałej (azotanu(V) potasu), jaką można rozpuścić w określonej objętości wody?
Im wyższa temperatura wody, tym więcej substancji (azotanu(V) potasu) można w niej rozpuścić.
zlewki,
palnik (czajnik),
płytka ceramiczna,
woda,
azotan(V) potasu.
Do dwóch zlewek wlej po 10 cmIndeks górny 33 wody różniącej się temperaturą (np. 20 i 50°C).
Wsyp do każdej z nich po 5 g azotanu(V) potasu.
Dokładnie mieszaj zawartość obu zlewek.
Porównaj ilość rozpuszczonej substancji w wodzie o różnej temperaturze.
Azotan(V) potasu nie rozpuścił się całkowicie w chłodnej wodzie, natomiast w ciepłej – tak. Ilość substancji rozpuszczonej w wodzie zależy od temperatury i w przypadku azotanu(V) potasu rośnie wraz z jej wzrostem.
Jaki wpływ na rozpuszczanie gazu w wodzie ma temperatura?
Wybierz jedną z przedstawionych hipotez, a następnie zweryfikuj ją.
Im wyższa temperatura wody, tym mniej gazu się w niej rozpuści (ilość gazu rozpuszczonego w wodzie maleje wraz ze wzrostem temperatury).
Im wyższa temperatura wody, tym więcej gazu się w niej rozpuści (ilość gazu rozpuszczonego w wodzie rośnie wraz ze wzrostem temperatury).
zlewki,
woda o temperaturze pokojowej,
wrzątek,
woda gazowana schłodzona w lodówce,
woda gazowana o temperaturze pokojowej.
Do trzech zlewek o identycznej objętości wlej jednakową objętość schłodzonej w lodówce wody gazowanej (kilkadziesiąt cmIndeks górny 33).
Do każdej z nich dodaj taką samą objętość „zwykłej” wody o różnej temperaturze:
do pierwszej zlewki – wodę schłodzoną w lodówce,
do drugiej zlewki – wodę o temperaturze pokojowej,
do trzeciej zlewki – wodę o temperaturze około 100°C (wrzątek).
Obserwuj pojawianie się pęcherzyków gazu w zlewkach. Porównaj ilość pęcherzyków.

Film dostępny na portalu epodreczniki.pl
Na stole laboratoryjnym znajdują się 3 zlewki o jednakowej objętości oraz butelka wody mineralnej. Do pierwszej wlewana jest schłodzona woda, do drugiej woda o temperaturze pokojowej, a do trzeciej woda gazowana. W zlewce 2 i 3 wydzielają się pęcherzyki gazu. W 3 jest ich najwięcej.
Po dodaniu gorącej wody do wody mineralnej wzrasta jej temperatura i wydzielają się z niej pęcherzyki gazu. Im wyższa była temperatura dodanej wody, tym więcej wydzielało się gazu. Wraz ze wzrostem temperatury maleje ilość gazu rozpuszczonego w wodzie.
Ilość substancji, która może ulec rozpuszczeniu w wodzie, zależy od temperatury. W przypadku gazów ilość ta maleje wraz ze wzrostem temperatury, natomiast dla ciał stałych wielkość ta na ogół rośnie.
3. Roztwór nasycony i nienasycony
Jeśli w roztworze wodnym znajduje się maksymalna ilość substancji rozpuszczonej, a kolejna dodana porcja substancji nie ulegnie już rozpuszczeniu, to mamy do czynienia z roztworem nasyconymroztworem nasyconym. Każdy inny roztwór, który nie osiągnął stanu nasycenia, określa się mianem roztworu nienasyconegoroztworu nienasyconego.
Z uwagi na zależność między ilością substancji rozpuszczonej od temperatury roztwór, który jest nasycony w temperaturze niższej, nie będzie już nim w temperaturze wyższej, w której najczęściej może rozpuścić się więcej substancji.
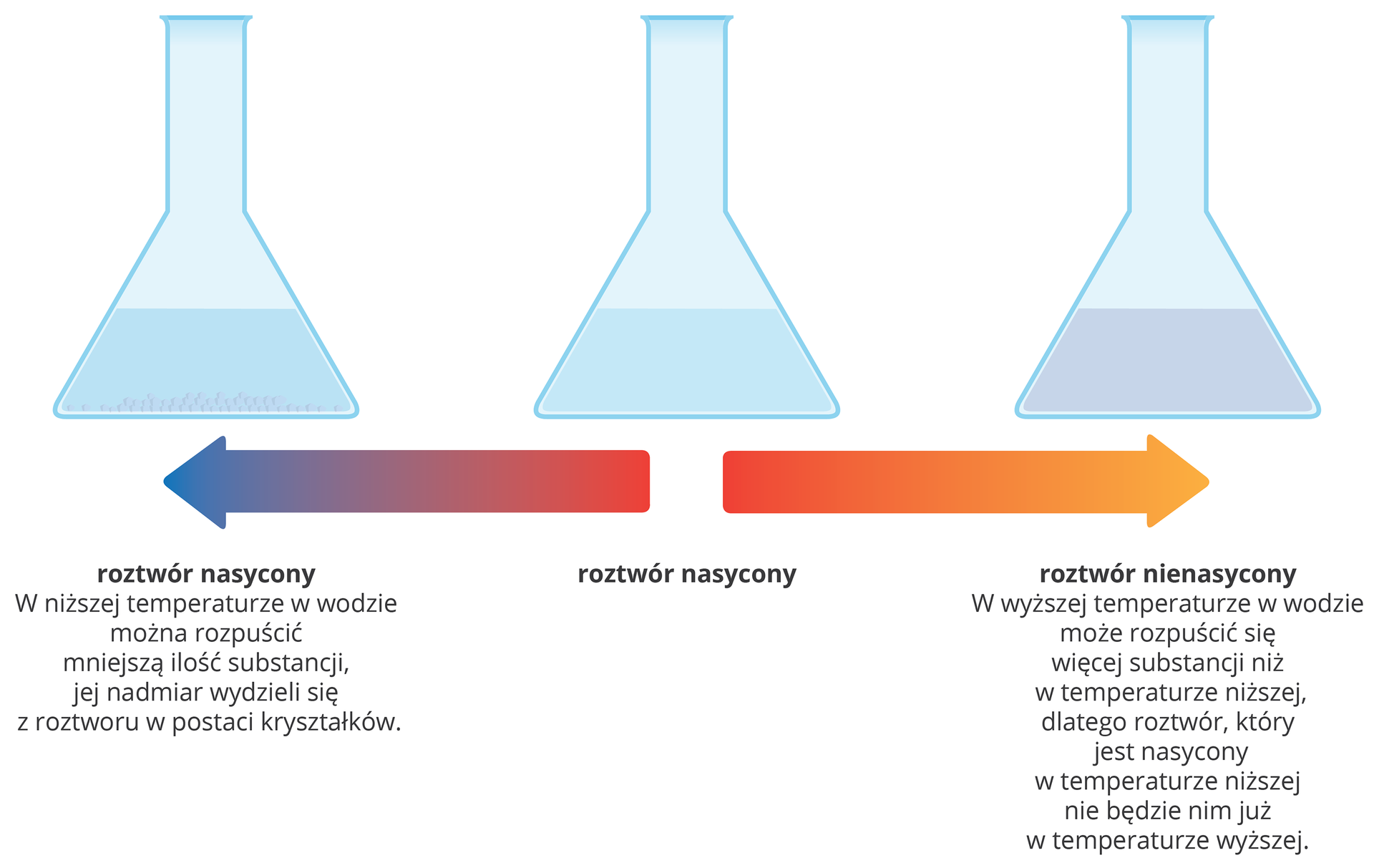
Chemicy posługują się także określeniami roztworów odnoszącymi się do ilości rozpuszczonej w nich substancji. Wyróżniają na tej podstawie:
roztwór stężonyroztwór stężony, w którym ilość substancji rozpuszczonej jest identyczna jak w roztworze nasyconym lub niewiele mniejsza;
roztwór rozcieńczonyroztwór rozcieńczony, czyli roztwór, który zawiera co najmniej kilkakrotnie mniej substancji niż roztwór stężony.

Każdy roztwór nasycony jest roztworem stężonym, ale nie każdy roztwór stężony jest nasyconym.
Każdy roztwór rozcieńczony jest jednocześnie nienasyconym, ale roztworem nienasyconym może być zarówno roztwór rozcieńczony, jak i stężony.

4. Rozpuszczalność
Żadna substancja nie może zostać rozpuszczona w wodzie w nieograniczonej ilości. Są substancje, które rozpuszczają się w niej tylko w niewielkim stopniu (np. w ilości g w 100 g wody). Istnieją też dobrze rozpuszczalne substancje, których ilość w roztworze może przekraczać czterokrotnie masę wody.
Miarą zdolności substancji do rozpuszczania się w wodzie jest rozpuszczalnośćrozpuszczalność. Określa ona maksymalną ilość substancji jaka może rozpuścić się w ustalonej masie lub objętości rozpuszczalnika w danej temperaturze i pod stałym ciśnieniem. W tablicach fizycznych i chemicznych rozpuszczalność jest najczęściej wyrażana jako liczba gramów substancji, którą można rozpuścić w 100 g wody w danej temperaturze i pod stałym ciśnieniem. Dane te zostały wyznaczone doświadczalnie.
Temperatura | Chlorek sodu | Cukier | Siarczan(VI) miedzi(II) | Azotan(V) potasu | Azotan(V) sodu | Jodek potasu | Octan sodu | Chlorek potasu |
35,7 | 179 | 14,3 | 13,3 | 73 | 127,5 | 36,0 | 27,6 | |
35,8 | 17,4 | 20,9 | 80 | 136 | 31,0 | |||
36,0 | 204 | 20,7 | 31,6 | 88 | 144 | 46,6 | 34,0 | |
36,3 | 25,0 | 45,8 | 96 | 152 | 37,0 | |||
36,6 | 238 | 28,5 | 63,9 | 104 | 160 | 66,4 | 40,0 | |
37,0 | 33,3 | 85,5 | 114 | 168 | 42,6 | |||
37,3 | 288 | 40,0 | 110,0 | 124 | 176 | 139,8 | 45,5 | |
37,8 | 47,1 | 138 | 184 | 48,1 | ||||
38,4 | 363 | 55 | 169 | 148 | 192 | 153,2 | 51,1 | |
39,0 | 64,2 | 202 | 200 | 54,0 | ||||
39,8 | 488 | 75,4 | 246 | 180 | 208 | 169,5 | 56,7 | |
Źródła: , , | ||||||||
Na podstawie danych zawartych w tabeli opisz, jak wraz z temperaturą zmienia się rozpuszczalność sacharozy, Czy ilość rozpuszczonej sacharozy rośnie czy maleje?
Temperatura | Dwutlenek węgla | Tlen | Azot | Wodór |
0,335 | 0,006948 | 0,00294 | 0,0001982 | |
0,232 | 0,005370 | 0,00231 | 0,0001740 | |
0,169 | 0,004339 | 0,00189 | 0,0001603 | |
0,126 | 0,003508 | 0,00162 | 0,0001474 | |
0,097 | 0,003081 | 0,00139 | 0,0001384 | |
0,076 | 0,002657 | 0,00121 | 0,0001287 | |
0,058 | 0,002274 | 0,00105 | 0,0001178 | |
– | 0,001857 | 0,0001021 | ||
– | 0,001381 | 0,00066 | 0,0000790 | |
– | 0,000787 | 0,0000461 | ||
– | 0,0000 | 0,0000 | 0,0000000 | |
Źródła: , | ||||
Porównaj, jak wraz z temperaturą zmienia się rozpuszczalność gazów i substancji stałych w wodzie.
5. Krzywe rozpuszczalności
Na podstawie danych liczbowych przedstawiających zależność rozpuszczalności substancji od temperatury sporządza się wykres nazywany krzywą rozpuszczalności.
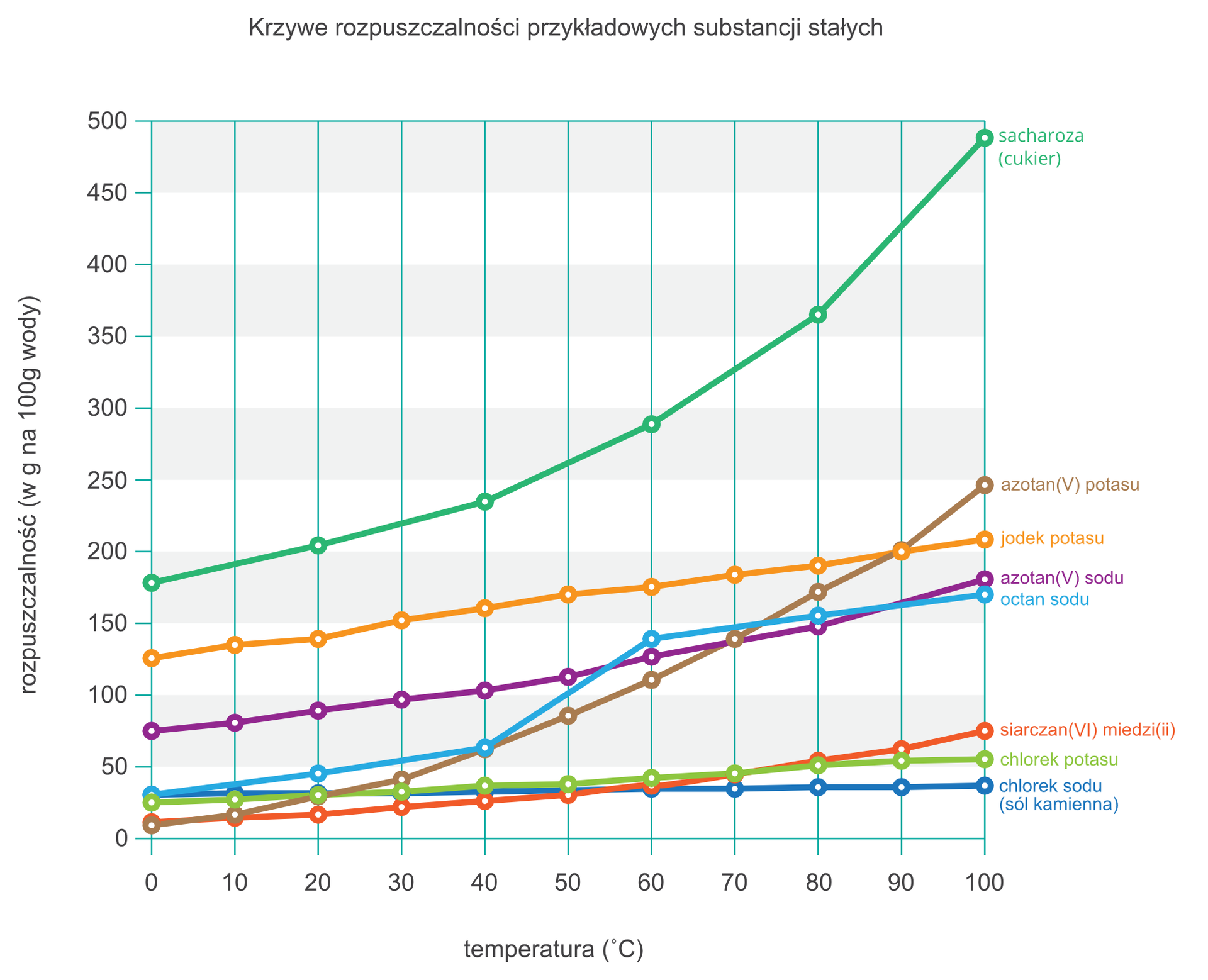
Krzywa rozpuszczalności pozwala określić, jak zmienia się rozpuszczalność danej substancji w zależności od temperatury. Dostarcza też informacji, czy jest to zmiana znaczna, czy niewielka. Z wykresu można też odczytać ilość substancji, jaka może maksymalnie rozpuścić się w 100 g wody.
Oczyszczanie substancji – krystalizacja
Otrzymywane w laboratorium związki chemiczne zazwyczaj nie są czyste i zawierają niewielkie ilości innych substancji nazywanych zanieczyszczeniami. Aby otrzymać czystą substancję, jako metodę oczyszczania stosuje się m.in. krystalizację. Polega ona na tym, że w odpowiednio dobranym rozpuszczalniku, w temperaturze jego wrzenia, rozpuszcza się zanieczyszczoną substancję, w wyniku czego otrzymuje się jej nasycony roztwór.
Następnie pozostawia się mieszaninę w spokoju przez pewien czas. W trakcie powolnego ochładzania mieszaniny substancja wydziela się z roztworu w postaci kryształów, a zanieczyszczenia pozostają w roztworze.
Warunkiem koniecznym do przeprowadzenia krystalizacji jest dobranie takiego rozpuszczalnika, w którym dana substancja będzie rozpuszczała się bardzo dobrze na gorąco, a słabo – w niższej temperaturze, a ponadto rozpuszczalnik ten – niezależnie od temperatury – będzie bardzo dobrze rozpuszczał zanieczyszczenia.

Podsumowanie
W takiej samej objętości wody rozpuszczają się różne ilości rozmaitych substancji.
Ilość substancji stałej rozpuszczonej w wodzie zależy od temperatury i najczęściej rośnie wraz z jej wzrostem.
Wraz ze wzrostem temperatury maleje ilość rozpuszczonego w wodzie gazu.
Roztwór, który w danej temperaturze zawiera maksymalną ilość substancji rozpuszczonej, a kolejna dodana porcja substancji nie ulega rozpuszczeniu, nazywamy roztworem nasyconym.
Roztwór, który w danej temperaturze nie zawiera maksymalnej ilości substancji
rozpuszczonej i w którym możliwe jest rozpuszczenie dodatkowej porcji substancji, to roztwór nienasycony.
Roztwór rozcieńczony zawiera co najmniej kilkakrotnie mniej substancji niż roztwór stężony.
W roztworze stężonym ilość substancji rozpuszczonej jest taka sama jak w roztworze nasyconym lub niewiele mniejsza.
Maksymalna ilość substancji, jaka może rozpuścić się w ustalonej masie lub objętości rozpuszczalnika w danej temperaturze i pod stałym ciśnieniem, nazywa się rozpuszczalnością. Może być wyrażana jako liczba gramów substancji, jaką można rozpuścić w 100 g rozpuszczalnika w danej temperaturze i pod stałym ciśnieniem.
Wykres przedstawiający zależność rozpuszczalności danej substancji od temperatury nazywa się krzywą rozpuszczalności.
Zaprojektuj doświadczenie pozwalające sprawdzić, czy woda wodociągowa zawiera rozpuszczony gaz.
Przygotuj nasycony roztwór cukru w wodzie w wybranej temperaturze.
Oblicz, jaką masę ma roztwór nasycony chlorku sodu w temperaturze 100°C, który powstał po rozpuszczeniu odpowiedniej ilości tej substancji w 100 g wody.
Słowniczek
wykres przedstawiający zależność rozpuszczalności danej substancji od temperatury
określa maksymalną ilość substancji, jaka może rozpuścić się w 100 g rozpuszczalnika w danej temperaturze i pod stałym ciśnieniem
roztwór, który w danej temperaturze zawiera maksymalną ilość substancji rozpuszczonej, a dodana kolejna do niej porcja substancji nie ulega rozpuszczeniu
roztwór, który w danej temperaturze nie zawiera maksymalnej ilości substancji rozpuszczonej i w którym można rozpuścić dodatkową porcję tej substancji
roztwór, który zawiera co najmniej kilkakrotnie mniej substancji rozpuszczonej niż roztwór stężony
roztwór, w którym ilość substancji rozpuszczonej jest taka sama jak w roztworze nasyconym lub niewiele mniejsza
Zadania
Uzupełnij luki w tekście. Wybierz właściwe określenia spośród podanych.
objętości roztworu, substancji rozpuszczonej, roztworu, substancji rozpuszczonej, masy substancji rozpuszczonej, masy rozpuszczalnika, rozpuszczalnika, rozpuszczalności, masy rozpuszczalnika, roztworu, temperatury, masy substancji rozpuszczonej, rozpuszczalnika
Rozpuszczalność to ilość .......................................................... znajdującej/ego się w 100 g ........................................................... Krzywa rozpuszczalności przedstawia zależność .......................................................... od ...........................................................
Oceń, czy podane zdania są prawdziwe, czy fałszywe.
| Prawda | Fałsz | |
| Wszystkie substancje w tej samej temperaturze mają jednakową rozpuszczalność. | □ | □ |
| Każdy roztwór nienasycony jest roztworem rozcieńczonym. | □ | □ |
| Rozdrobnienie substancji użytej do sporządzenia roztworu nasyconego ma wpływ na jej rozpuszczalność. W 100 g wody rozpuści się więcej substancji rozdrobnionej niż nierozdrobnionej. | □ | □ |
| Rozpuszczalność gazów rośnie wraz z obniżaniem temperatury. | □ | □ |
| Każdy roztwór nasycony jest roztworem stężonym. | □ | □ |
| Nie wszystkie substancje tworzą roztwory nasycone. | □ | □ |
| Rozpuszczalność zależy od mieszania substancji podczas sporządzania roztworu. | □ | □ |
Na podstawie wykresu rozpuszczalności uszereguj substancje według rozpuszczalności (rosnąco) w temperaturze 60°C.
- azotan(V) potasu
- cukier (sacharoza)
- chlorek potasu
- octan sodu
- chlorek sodu
- siarczan(VI) miedzi(II)
- azotan(V) sodu
- jodek potasu
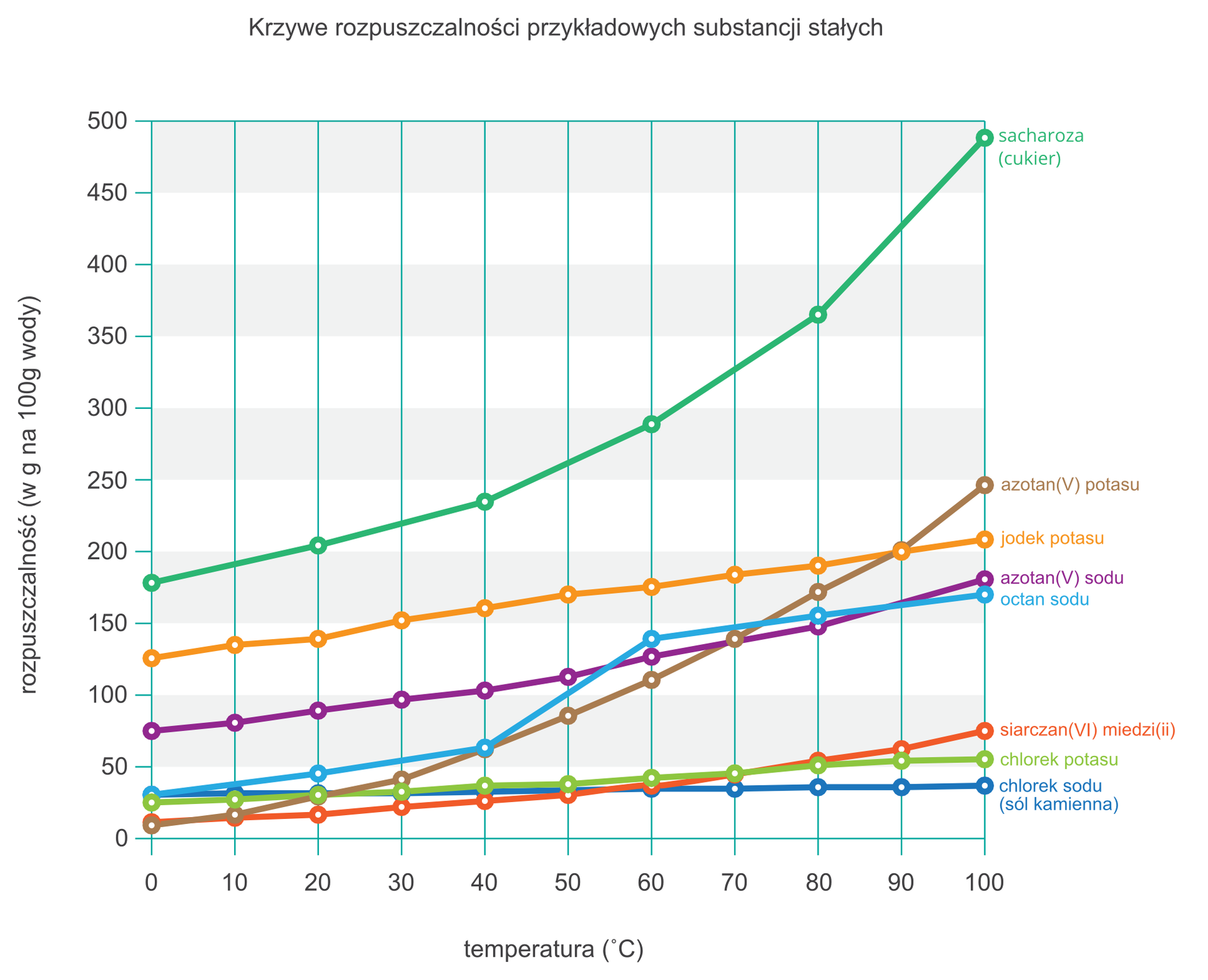
Określ rozpuszczalność poniższych substancji w wodzie o temperaturze 80°C. Przyporządkuj ich nazwy do poszczególnych kategorii w zależności od maksymalnej ilości substancji, jaką można rozpuścić w 100 g wody.
siarczan(VI) miedzi(II), chlorek potasu, jodek potasu, chlorek sodu, cukier (sacharoza), octan sodu, azotan(V) sodu, azotan(V) potasu
| rozpuszczalność od 10 do 40 g /100 g wody | |
|---|---|
| rozpuszczalność od 41 do 100 g /100 g wody | |
| rozpuszczalność powyżej 100 g /100 g wody |
Rozpuszczalność pewnej substancji maleje wraz ze wzrostem temperatury. Na podstawie tej informacji oceń, czy podane zdania są prawdziwe, czy fałszywe.
| Prawda | Fałsz | |
| Roztwór, który w temperaturze 10°C jest roztworem nasyconym, po ogrzaniu do temperatury 50°C stanie się roztworem nienasyconym. | □ | □ |
| Podczas schładzania roztworu nasyconego wydzieli się z niego rozpuszczona substancja. | □ | □ |
| Aby z roztworu nasyconego o temperaturze 20°C otrzymać roztwór nasycony o temperaturze70°C, konieczne będzie dodanie substancji po ogrzaniu roztworu. | □ | □ |
| W 100 g rozpuści się więcej substancji, jeśli woda będzie miała wyższą temperaturę. | □ | □ |
| Roztwór, który w temperaturze 60°C jest roztworem nasyconym, w temperaturze niższej stanie się roztworem nienasyconym. | □ | □ |
Proces krystalizacji jest jedną z metod oczyszczania substancji. Polega na rozpuszczeniu zanieczyszczonej substancji w odpowiednio dobranym rozpuszczalniku, w wysokiej temperaturze. Podczas stygnięcia oczyszczana substancja wydziela się z roztworu, a zanieczyszczenia pozostają w rozpuszczalniku.
Na podstawie powyższych informacji oceń, które zdania dotyczące rozpuszczalnika zawierają informacje prawdziwe, a które – fałszywe.
| Prawda | Fałsz | |
| Dobrze rozpuszcza substancję oczyszczaną zarówno na gorąco, jak i w temperaturze niższej. | □ | □ |
| Dobrze rozpuszcza zanieczyszczenia w każdej temperaturze. | □ | □ |
| Dobrze rozpuszcza substancję oczyszczaną w wysokiej temperaturze, słabo zaś w temperaturze niższej. | □ | □ |
Proces krystalizacji jest jedną z metod oczyszczania substancji. Polega na rozpuszczeniu w wysokiej temperaturze zanieczyszczonej substancji w odpowiednio dobranym rozpuszczalniku. Podczas stygnięcia oczyszczana substancja wydziela się z roztworu, a zanieczyszczenia pozostają w rozpuszczalniku.
Na podstawie powyższych informacji oceń, które zdania dotyczące substancji oczyszczanej zawierają informacje prawdziwe, a które – fałszywe.
| Prawda | Fałsz | |
| Dobrze rozpuszcza się w rozpuszczalniku w każdej temperaturze. | □ | □ |
| Dobrze rozpuszcza się w rozpuszczalniku na gorąco, a słabo – w niższej temperaturze. | □ | □ |
| Jej rozpuszczalność w rozpuszczalniku maleje wraz z obniżaniem temperatury. | □ | □ |
| Jej rozpuszczalność jest zbliżona do rozpuszczalności zanieczyszczeń. | □ | □ |